
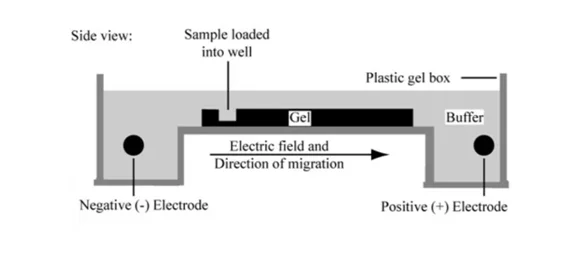
الکتروفورز ژل آگارز افقی
ژل الکتروفورز آگارز معمولا برای جداسازی قطعات DNA و RNA استفاده می شود. اساس جداسازی برای تکنیک الکتروفورز حرکت یک مولکول باردار در یک محیط تحت یک میدان الکتریکی است، که مطابق فرمول زیر مولکولها حرکت می کنند.
V=Eq/f
V سرعت حرکت مولکول است. E میدان الکتریکی بر حسب ولت بر سانتی متر است ، q بار خالص مولکول و f ضریب اصطکاک است. تأثیر f به جرم و شکل مولکول بستگی دارد. این معادله به سادگی
توضیح میدهد که سرعت (v) یک ذره به میدان الکتریکی و بار بستگی دارد اما f تاثیر عکس بر سرعت حرکت دارد. از عوامل موثر بر f اندازه و شکل مولکول است.
حرکت مولکول (µ) در ژل آگارز با غلظت آگارز (ι) مرتبط است.
log µ = log µ0 – Kr ι
µ0 = حرکت آزاد DNA در محلول
Kr = ضریب کاهش سرعت
ι = غلظت آگارز
معادله بالا میگوید غلظت آگارز بر طیف تفکیک مولکولها تأثیر می گذارد. هرچه درصد آگارز در یک ژل بیشتر باشد، آگارز متراکم تر و منافذ کوچکتری در ژل جامد بوجود می آید. از غلظتهای متفاوتی از آگارز برای جدا سازی مولکولهای با اندازه مختلف استفاده می شود.
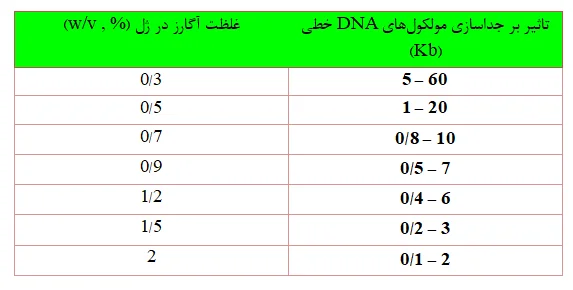
بار منفی فسفات که بر روی DNA وجود دارد باعث جذب DNA به سمت الکترود مثبت می شود. رشته DNA بزرگتر بار بیشتری را در خود ذخیره می کند و در نتیجه سرعت حرکت آن بیشتر خواهد بود.اندازه و شکل مولکول DNA بر روی حرکت آن در منافذ ژل تاثیر دارد. برای مثال یک پلاسمید Kb 5/2 را در نظر بگیرید. از یک پلاسمید خالص 3 تا 4 باند در الکتروفورز وجود دارد. که دلیل اندازه های متفاوت باندهای مربوط به یک پلاسمید سرعت
متفاوت حرکت شکلهای مختلف پلاسمید در ژل اگارز است.
بافر ها
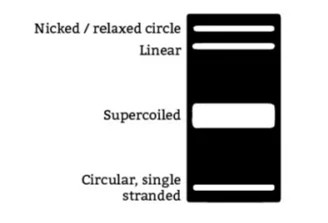
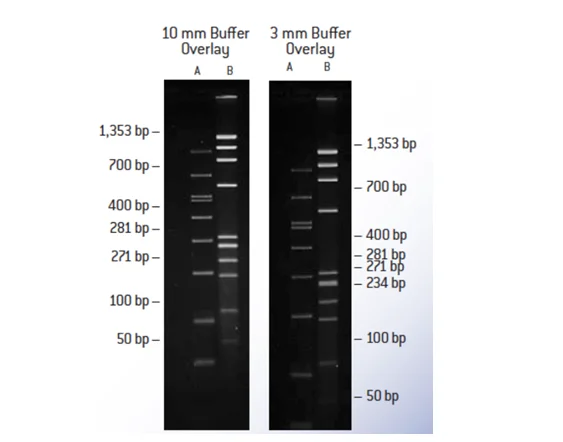
در تکنیک الکتروفورز برای حرکت DNA در ژل نیاز به بافر است که بافرهای مختلفی برای این کار وجو دارد که رایجترین آنها TAE و TBE میباشد. هر ژل و بافر باید با استفاده صحیح آن مطابقت داشته باشد. بافر TAE برای جدا سازی قطعات بزرگ DNA در ژل آگارز استفاده میشود و سازگاری زیادی با واکنشهای آنزیمی دارد. بهتر است برای تخلیص DNA از روی ژل از بافر TAE استفاده شود. بافر TBE برای جدا سازی قطعات کوچک (کمتر از Kb 1) استفاده می شود. در شکل زیر تفاوت در جدا سازی قطعات در بافر TAE و TBE بخوبی قابل مشاهده است. قطعات بزرگ DNA در بافر TAE با درصد آگارز کمتر، تفکیک باند بهتری را ایجاد میکند در صورتیکه قطعات بزرگ DNA در بافر TBE و در صد زیاد از اگارز تفکیک کمی دارد و بهتر است برای جداسازی و تفکیک قطعات بزرگ از بافر TAE استفاده شود.
برای قطعات کوچک نیز همانطور که در شکل مشاهده میشود درصد آگارز بیشتر و بافر TBE تفکیک بهتری ایجاد میکند.
1- هنگام تخلیص قطعات DNA از ژل اگارز بهتر است از این بافر استفاده شود.
2- برای قطعات DNA بیشتر از Kb 12 استفاده شود.
3- این بافر قدرت یونی کمی دارد.
4- ظرفیت بافر کم است. ممکن است نیاز به گردش مجدد برای مدت زمان طولانی ران شدن داشته باشد.
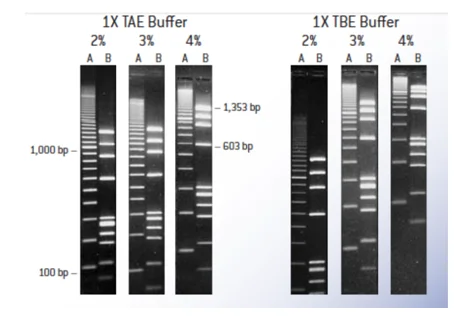
ویژگیهای بافر TBE:
1- برای قطعات کمتر از Kb 1 استفاده شود. اگر درصد آگارز بیشتری استفاده شود تفکیک باند وضوح بهتری دارد.
2- قدرت یونی بالایی دارد.
3- ظرفیت یونی زیادی دارد.
4- هنگام تخلیص قطعات DNA از ژل آگارز نباید از این بافر استفاده شود.

عمق بافر در الکتروفورز افقی
مناسب: روی ژل باید 3 – 5 میلیمتر باشد.
زیاد :باعث تخریب باندها، گرم شدن و ذوب شدن نسبی ژل میشود.
کم :باعث خشک شدن ژل میشود. ذوب شدن ژل و اسمیر شدن باندها گویای کاهش ظرفیت pH بافر یا ژل است. این مورد بیشتر در ژلهای بزرگ و رانهای طولانی مدت مشاهده میشود. ژلهای کوچک این مشکل را نخواهند داشت.
تاثیر عمق بافر روی DNA در ژل در شکل بخوبی مشاهده می شود. به از دست رفتن شارپ بودن
باندها در عمق زیاد بافر روی ژل دقت شود.
مواد و وسايل لازم براي انجام تکنیک الكتروفورز ژل آگارز عبارتند از:
بافر TAE، سينی و شانه مخصوص ژل آگارز، تانك الكتروفورز افقی ، منبع تغذيه الکتروفورز، نمونه های DNA، بافر نمونه گذاری ،
مارکر ملكولی 100bp و 1Kb، Gel stain، دستگاه مشاهده و عکس برداری از ژل.
تهيه ژل آگارز 1%
یک گرم از پودر آگارز را در ۱۰۰ میلی لیتر TAE(X1) مخلوط کنید. اگر مخلوط بدست آمده را حرارت دهید یک محلول شفاف بدست می آید. سپس به ازای هر ml 20،µl 1 رنگ DeNA Gel Stain(رنگ DNA سیف استین) اضافه کرده و آن را هم بزنید تا بطور یکنواخت در ژل حل شود. با آماده كردن شانه و قرار دادن بر روي سينی مخصوص، محلول را در سينی ريخته بطوری که در دمای آزمايشگاه سفت شود. پس از آن، شانه را خارج کرده و از چاهكهای بر جاي مانده به عنوان محل قرار دادن نمونه استفاده گرديد. بافر نمونه گذاري (Loading dye) براي پر كردن چاهکها به وسیله نمونههاي DNA، لازم است ابتدا نمونه ها با بافر نمونه گذاري مخلوط شوند، تا بدين وسيله با اضافه شدن چگالي، محلول DNA بتواند به ته چاهك رسوب نمايد و همچنین با رنگ ایجاد شده جهت و میزان حرکت نمونه ها مشخص شود.
افزايش چگالي نمونهDNA به دليل وجود گليسيرين در بافر ميباشد. بروموفنل بلو و زايلن سيانول مواد رنگي ميباشند كه در ژل نوارهاي رنگي توليد ميكنند.و پيشرفت الكتروفورز را نشان ميدهند. محل حركت نوارهاي رنگي، تخميني از نحوه الكتروفورز و جدا شدن ملكول هاي DNA از يكديگر ميباشد.

رنگ آمیزی ژل آگارز
همانگونه که بالاتر توضیح داده شد، برای رنگ آمیزی ژل از موادی مثل اتیدیوم برماید، سایبرگرین و یا DeNA Gel Stain استفاده میشود . رنگ DeNA Gel Stain یک رنگ DNA تولید شده در شرکت دنا ژن تجهیز میباشد که کیفیتی همتای اتیدیوم برماید دارد ولی به لحاظ سرطانزایی و تست ایمز جز رنگهای خانواده safe میباشد. سایبرگرین و DeNA Gel Stain عملی مشابه اتيديوم برومايد دارند و برخلاف آن، ایمن بوده و مضرات اتيديوم برومايد را ندارند.
مشکلات احتمالی تکنیک الکتروفورز آگارز و دلایل
دلایل شدت باند کم در تکنیک الکتروفورز
1- ممکن است مقدار ناکافی از DNA و یا Ladder لود شده باشد. (تقریبا 100 – 200 نانوگرم در هر چاهک با قطر ژل mm 1 بارگذاری شود).
2- ممکن است مقدار ناکافی از ماده رنگ آمیزی ژل استفاده شده باشد.
3- ممکن است DNA از ژل خارج شده باشد. الکتروفورز را تا زمانی انجام دهید که رنگ آبی بروموفنل از دو سوم ژل عبور کند. اطمینان حاصل کنید که ژل در طول مدت زمان run در بافر غوطه ور شده باشد.
4- از الکتروفورز طولانی مدت ژل با ولتاژ زیاد خود داری کنید زیرا DNAهای کوچک سرعت حرکت زیادی دارند و از ژل خارج می شوند.
5- بلافاصله بعد از انجام الکتروفورز عکسبرداری از ژل را انجام دهید زیرا بعد قطع ولتاژ قطعات کوچک DNA در ژل شروع به
پخش شدن میکنند و در ژل پخش میشوند و در زمان عکس برداری شدت باند کم دیده میشود.
6- ممکن است باند DNA توسط Dye پوشیده شده باشد و شدت باند کم دیده شود. در این حالت اجازه دهید الکتروفورز زمان بیشتری انجام شود تا Dye از روی باند DNA خارج شود.
دلیل اسمیر شدن باندهای DNA در تکنیک الکتروفورز
1- ممکن است DNA توسط نوکلئازها تخریب شده باشد. از بافرهای الکتروفورز تازه، ژلهای تازه ریخته شده، ویالهای فاقد نوکلئاز و نکاتی برای به حداقل رساندن آلودگی نوکلئاز به محلولهای DNA استفاده کنید.
2- شرایط نا مناسب الکتروفورز باعث اسمیر شدن باندها میشود:
2-1- همیشه از همان بافری که برای تهیه ژل استفاده شده است برای تانک الکتروفورز استفاده شود. ا طمینان حاصل کنید که کل ژل در طول اجرای ران کاملا در بافر الکتروفورز غوطه ور شده است.
2-2- از ولتاژ بیش از حد زیاد منبع تغذیه برای الکتروفورز استفاده نکنید. ژلها را با 5-8 ولت بر سانتی متر اجرا کنید.
2-3- برای افزایش وضوح باند، در ابتدای الکتروفورز برای چند دقیقه از ولتاژ کمتری استفاده کنید.
2-4- ولتاژ بیش از حد کم در طول مدت زمان اجرای الکتروفورز ممکن است منجر به پخش باندها در طول الکتروفورز شود.
2-5- ولتاژ بیش از حد زیاد ممکن است منجر به گرم شدن ژل و دناتوراسیون DNA شود.
2-6- برای محاسبه میزان ولتاژ از مقدار توصیه شده که معمولا v/cm 5-8 است به صورت زیر عمل میشود: ابتدا فاصله بین الکترودها را اندازه بگیرید (مقدار بدست آمده را X بنامید). مقدار X را در ولتاژ توصیه شده ضرب کنید و ولتاژ بدست آمده را اعمال کنید.
3- پروتئینهای متصل به DNA، مانند لیگازها، فسفاتازها یا آنزیمهای محدود کننده، ممکن است حرکت DNA روی ژلها را تغییر
داده و باعث باقی ماندن DNA در چاهک ژل یا gel shifting شود. برای حذف اثرات gel shifting، میتوان از محلول 6X DNA Loading Dye و SDS استفاده کنید که با 1٪ SDS برای از بین بردن پیوندهای DNA-پروتئین استفاده میشود. همیشه این نمونه ها را با SDS در دمای 65 درجه سانتیگراد به مدت 10 دقیقه حرارت دهید، روی یخ سرد کنید، spin کنید و در ژل بارگذاری
کنید.
4- بارگذاری بیش از حد مقدار DNA یکی دیگر از دلایل اسمیر شدن باند است.
5- غلظت بالای نمک در نمونه باعث اسمیر شدن باند میشود.
6- چاهکهای کج یکی دیگر ار دلایل اسمیر دیده شدن باندها است. هنگام ریختن ژل در سینی دقت کنید که شانه به صورت عمودی روی کاست قرار گرفته باشد.
دلایل مربوط به الگوی باندی نامتعارف:
1- ممکن است بافر مورد استفاده نادرست انتخاب شده باشد. بافر TAE برای جداسازی قطعات DNA بزرگتر از bp 1500 و برای DNAهای supercoil توصیه میشود. بافر TBE برای قطعات DNA کوچکتر از 1500 جفت باز استفاده می شود. قطعات بزرگ DNA در بافر TBE به خوبی جدا نمی شوند.
2- ممکن است درصد ژل نادرست انتخاب شده باشد مقدار آب ژل را طوری تنظیم کنید که موقع جوشیدن مقداری از آن
تبخیر می شود. جوشیدن زیاد باعث تبخیر مقدار زیادی از آب ژل شده باعث تغییرغلظت آگارز میگردد. درصد ژل بیش از حد بالا منجر به جداسازی نامناسب باندهای بزرگتر DNA می شود.
3- اثر gel shifting که در بالا توضیح داده شد دلیل دیگر باندهای غیر متعارف در الکتروفورز است.
4- نمونه هایی با غلظت نمک بالا ممکن است الگوهای باند اسمیر یا shift شده ایجاد کنند. برای حذف نمک از رسوب با اتانول و
سرما استفاده شود. سپس رسوب DNA را در اتانول 70 درصد شستشو داده و رسوی را در بافر TE یا آب حل کنید.
دلایل ایجاد باندهای منحنی شکل:
1- ژل بطور کامل در بافر غوطه ور نباشد. بافر الکتروفورز باید در هنگام بارگذاری نمونه، کل ژل را بپوشاند.
2- حجم نمونه بار گذاری شده کم باشد.
حجم نمونه یا Ladder باید به اندازه کافی باشد تا بتواند یک سوم از ظرفیت کل چاهک را پر کند. از چاهکهای بزرگ نباید برای حجم کم نمونه استفاده شود. در صورت نیاز، برای افزایش حجم نمونه می توان آن را با بافر بارگذاری 1X مخلوط کرد.
3- شرایط نا مناسب الکتروفورز یکی دیگر از دلایل است. از ولتاژ بالا برای الکتروفورز استفاده نکنید. محاسبه ولتاژ مناسب در بالا توضیح داده شد.
4- حباب یا ذرات جامد در ژل یا چاهکها نیز میتواند چنین مشکلی را ایجاد کند. برای تهیه ژل از آب خالص، مواد تمیز و ظروف
تمیز استفاده کنید. ژل را به آرامی در سینی ریخته تا هنگام ریختن ژل از ایجاد حباب جلوگیری کنید. حبابها را می توان با نوک پیپت از بین برد.
Sambrook J, Fritsch EF, Maniatis T (1989) Molecular Cloning, A Laboratory Manual.
Fermentase, Troubleshooting Guide for DNA Electrophoresis.
2 Tray
3 Loading dye
4 Ladder
5 Gel Documentation




