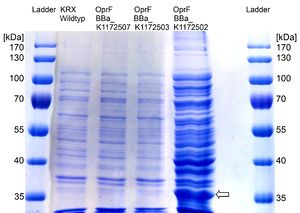
آماده سازی نمونه در تکنیک SDS-PAGE
برای آماده سازی نمونه در تکنیک SDS-PAGE بافر نمونه را با نسبت خاصی به نمونه می افزایند، سپس برای دقایقی در آب جوش قرار میدهند. در این شرایط پروتئین ها به واسطه اثر SDS و ماده احیاکننده (در حالت الکتروفورز احیایی) کاملا دناتوره می شوند. میزان SDS در بافر نمونه باید بارها بیشتر از میزان پروتئین باشد (میزان 3 به 1) تا کاملا از اشباع شدن پروتئین با SDS اطمینان حاصل شود.
وجود گلیسرول یا ساکارز در بافر نمونه باعث سنگین شدن نمونه و قرار گرفتن آن در ته چاهک می شود. این موضوع خصوصا زمانی اهمیت بالایی پیدا میکند که مدت زمان نمونه گذاری زیاد طول بکشد. در تکنیک SDS-PAGE معمولا بعد از افزودن بافر نمونه به پروتئین و قبل از نمونه گذاری، مخلوط آنها را دقایقی (15 -20 دقیقه بسته به نوع پروتئین) در آب جوش قرار می دهند. حرارت موجب جداشدن زیرواحدهای پروتئین های چند زیرواحدی و تسهیل اشباع شدن زنجیرهای پلی پپتیدی با استفاده از SDS می شود. بعلاوه، این کار موجب غیر فعال شدن بسیاری از پروتئازها شده و امکان تجزیه پروتئین ها توسط آنها را از بین خواهد برد. اما با این وجود بسیاری از پروتئازها در این شرایط سالم باقی می مانند و لازم است مهار کننده پروتئاز به نمونه ها افزوده شود.
بعضی پروتئین ها تحت تاثیر SDS تنها، رفتاری مشابه با حالت تحت تاثیر SDS و حرارت دارند ولی بعضی پروتئین ها در هر حالت رفتار متفاوتی از خود بروز می دهند. مواد لازم جهت انجام SDS-PAGE محلول استوک اکریلآمید (30.8 درصد):
30 گرم آکریل آمید و 0.8 گرم بیس اکریل آمید را زیر هود وزن کنید و در آب مقطر تا حجم نهایی 100 میلی لیتر حل نمایید. محلول را با کاغذ واتمن شماره 1 صاف کنید و در ظرف تیره بریزید. این محلول تا 3 ماه در یخچال قابل استفاده است.
نکته مهم: از استنشاق پودر اکریل آمید و بیس اکریل آمید در هنگام توزین و تماس با محلول آنها خودداری نمایید.
بافر ژل پایین:
18.2 گرم تریس باز و 0.4 گرم SDS را در 70 میلی لیتر آب مقطر حل نمایید. PH محلول را با اسید کلریدریک 2 مولار به 8.8 برسانید. سپس آب مقطر تا حجم نهایی 100 میلی لیتر اضافه کنید. غلظت تریس در این بافر 1.5 مولار است.
بافر ژل بالا:
6.1 گرم تریس باز و 0.4 گرم SDS را در 50 میلی لیترآب مقطر حل نمایید. با اسید کلریدریک 2 مولار PH آن را به 6.8 برسانید. سپس آب مقطر تا حجم نهایی 100 میلی لیتر اضافه کنید. غلظت تریس در این بافر 0.5 مولار است.
بافر الکترود (بافر مخازن): 3 گرم تریس باز، 14.4 گرم گلیسین و 1 گرم SDS را در 1 لیتر آب مقطر حل کنید، PH این بافر حدود 8.3 می باشد و نیاز به تنظیم ندارد.
بافر نمونه (5X): 10 میلی لیتر بافر ژل بالا، 5 میلی لیتر گلیسرول، 1 گرم SDS، 0.2 میلیلیتر محلول بروموفنل بلو (0.5 درصد در اتانول) و 1 میلی لیتر 2-مرکاپتواتانول را در یک ظرف مخلوط نمایید. سپس با آب مقطر به حجم نمایی 20 میلی لیتر برسانید.
پرسولفات آمونیوم 10 درصد: 1/0 گرم پرسولفات آمونیوم در 1 میلی لیتر آب مقطر حل کنید. این محلول باید تازه تهیه شود.
تمد (TEMED) 10 درصد: 1/0 میلیلیتر TEMED در 9/0 میلی لیتر آب مقطر حل کنید. این محلول باید به صورت تازه تهیه شود.
مارکرهای وزن مولکولی نیز آماده باشند.
انجام آزمایش
ابتدا قبل از انجام هرگونه آزمایش باید پلیت ها، اسپیسرها و شانه ها در یک دترجنت آزمایشگاهی شسته شوند. دقت شود که از مواد خورنده جهت شست وشو استفاده نشود. در صورتی که ژل برای مراحل بعد مانند رنگ آمیزی با نقره مورد نیاز باشد، توصیه میشود که شیشه ها را به صورت شبانه در کرومیک اسید انکوبه نمایید و سپس با آب مقطر شسته و در نهایت با اتانول، استون و اتانول به ترتیب شست وشو دهید. هیچگاه اجازه ندهید کرومیک اسید و یا حلال های آلی با ترکیبات پلاستیکی تماس داشته باشند. در نهایت شیشه ها را با دستان پوشیده شده با دستکش تمیز بردارید.
سر هم کردن پلیت ها (به روش الکتروفورزهای شرکت دنا ژن تجهیز)
ابتدا اسپیسرها و کامبها را در دترجنت معمولی آزمایشگاهی پاک نمایید. در صورت نیاز به تمیزکاری اختصاصی، شیشه ها میتوانند به صورت شبانه در کرومیک اسید بمانند؛ سپس با آب شستشو داده شوند و دوباره با اتانول، استون و دوباره اتانول شسته شوند. هرگز اجازه ندهید حلال های ارگانیک و یا کرومیک اسید با اجزای پلاستیکی در تماس باشند.
پلیت های تمیز را با دستهای تمیز و دستکش دار بردارید (هرگونه اثر را نیز با استون پاک نمایید).

همانطور که در شکل زیر ملاحظه می کنید سرهای فضاساز (spacer) به دو شکل تخت و مقعر می باشد.

در صورتی که در دفعات ابتدایی به دلیل تراز نکردن درست شیشه ها و اسپیسر توسط کاربر، ژل از پایین اسپیسر و شیشه ها نشت کند می توان با قراردادن قسمت مقعر اسپیسر در پایین شیشه ها و زدن مقدار کمی وازلین به محل مشخص شده مطابق شکل زیر از نشتی تانک جلوگیری کرد.
سر تخت اسپیسر بدون نیاز به وازلین، در مواردی که شخص به درستی شیشه ها و اسپیسر را با هم تراز کرده باشد مورد استفاده قرار می گیرد.
آماده سازی محفظه داخلی تانک الکترو فورز عمودی
بدین جهت ابتدا محفظه داخلی را روی سطح تمیز قرار داده و شیشه U شکل را در محل مورد نظر گذاشته سپس دو اسپیسر در کناره های شیشه قرار داده می شود؛ سپس شیشه تخت روی آنها گذارده می شود. و قطعات اورینگ با پیچ های پلاستیکی روی آن بسته میشود. توجه شود که نباید پیچ ها را در آن حالت سفت کرد بلکه محفطه را به شکل عمود روی میز قرار داده و با فشار دادن شیشه ها و اسپیسر از بالا با انگشت اقدام به سفت کردن پیچ ها میشود.
در صورتی که این کار به درستی انجام شود، شیشه ها و اسپیسر با هم در یک راستا و هم سطح پایه های تانک قرار می گیرند انگشت نشانه خود را در طول لبه های پایینی شیشه ها حرکت دهید تا از تراز بودن آنها با لبه پایینی هر اسپیسر اطمینان حاصل نمایید. در این حالت کمی پیچ ها را محکم کرده و محفظه را به شکل افقی خوابانده و شروع به بستن کامل پیچها به کمک آچار آن می کنیم. این عمل را برای طرف دیگر تانک نیز انجام می دهیم. در ادامه محفظه داخلی را به روی ژل کست قرار داده و پین های ژل کست را بچرخانید (از سمت O به C ). همچنان که پین ها را سفت می کنیم مقاومت زیادتر می شود. سپس عمل ژل ریزی را انجام داده و شانه ها را برای ایجاد چاهک بین فضای دو شیشه قرار می دهیم.
درب دستگاه را روی آن قرار دهید و کابل های پاور به طور صحیح وصل نمایید. ابتدا مطمین شوید که دستگاه پاور سوپلای خاموش میباشد؛ حالا سیستم جهت ران شدن آماده است.
ریختن ژل پایین تانک الکتروفورز (ژل جدا کننده)
محلول ژل پایین را از اجزای آن با توجه به درصد آن تهیه نمایید. نحوه تهیه 12 میلیلیتر از محلول ژل پایین در جدول زیر آمده است.
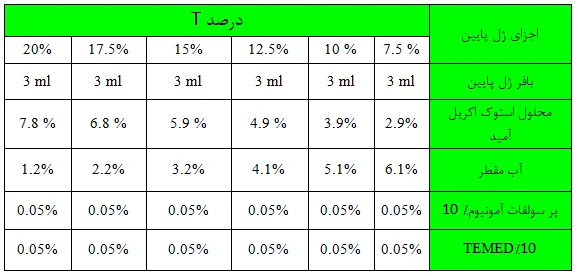
اجزای ژل پایین به غیر از TEMED را در یک ظرف مناسب مخلوط نمایید. محلول را حدود 30 ثانیه با پمپ خلا از هوا تخلیه کنید. سپس TEMED را اضافه کنید. پس از هم زدن سریع، محلول را در بین شیشه ها تا ارتفاع مناسب بریزید. باید دقت شود که حدود 3 سانتیمتر فضا برای ژل بالا لازم میباشد.
حدود 0.5 میلیلیتر آب مقطر با سمپلر به آرامی از کنار شیشه روی سطح ژل بریزید، به نحوی که با ژل مخلوط نگردد. انعقاد ژل پایین معمولا 15-45 دقیقه طول می کشد. ژل منعقد شده به وضوح از آب مقطر روی آن (به دلیل تفاوت در ظریب شکست نور) قابل تشخیص می باشد.
ژل بالای تانک الکتروفورز (ژل متراکم کننده)
بعد از انعقاد ژل پایین، مطابق جدول زیر ژل بالا را تهیه نمایید.
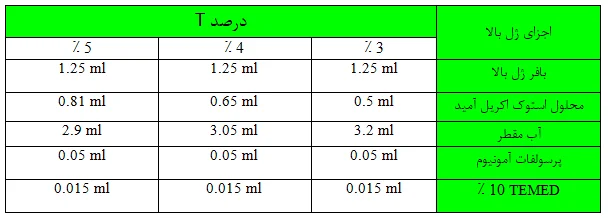
معمولا غلظت این ژل 3، 4 و یا 5 ٪ است. اجزای ژل بالا غیر از TEMED را در ظرف مناسبی مخلوط کنید. آب روی ژل پایین را کاملا خالی کنید. برای حذف قطرات باقیمانده آب، حدود 1 میلی لیتر محلول ژل بالا را در جدار داخلی شیشه بگردانید و مجددا تخلیه نمایید. به بقیه محلول ژل بالا TEMED اضافه نمایید و پس از هم زدن سریعا تا ارتفاع مناسب روی ژل پایین بریزید؛ سپس شانه را با دقت در ژل بالا فرو کنید، به طوری که دندانه های آن حدود 1.5 سانتی متر از سطح ژل فاصله داشته باشند. معمولا ژل بالا در کمتر از 15 دقیقه می بندد (کناره دندانه های شانه از ژل منعقد شده قابل تشخیص است). بهتر است قبل از دو آوردن شانه، انتهای دندانه آن را روی شیشه با ماژیک مشخص کنید تا نمونه گذاری و تشخیص چاهک ها راحت باشد.
آماده سازی جهت ران کردن تانک الکتروفورز عمودی
پس از بسته شدن ژل بالا، شانه ها را از آن خارج نموده و دستگاه را به دورن تانک الکتروفورز عمودی قرار دهید. مخازن تانک و دستگاه را تا ارتفاع مناسب به ترتیب با بافر الکترود و بافر نمونه پر کنید. هر گونه حباب در انتهای ژل را با تزریق بافر توسط سرنگ خارج نمایید.
افزودن نمونه ها به ژل آگارز در تکنیک SDS-PAGE
یک حجم بافر نمونه (5 X) را به 4 حجم نمونه پروتئین اضافه نمایید. اگر پروتئین به صورت پودر است، مقدار مورد نیاز آن را در بافر نمونه که 5 بار با آب مقطر رقیق شده (بافر 1 X) ، حل کنید. نمونه و بافر نمونه را در یک ظرف کوچک درب دار ریخته و به مدت 5 دقیقه در ظرف آب جوش قرار دهید. در صورت کدورت نمونه و یا وجود ذرات نامحلول، آن را به مدت 10 دقیقه در دور 10/000 g. سانتریفیوژ نمایید. سپس با سرنگ هامیلتون یا سمپلر مناسب 10-20 میکرولیتر از هر نمونه را به دقت در چاهک بریزید. به دلیل وجود گلیسرول، نمونه در ته چاهک قرار می گیرد. مقدار پروتئین موجود در هر چاهک به میزان خلوص نمونه و روش رنگ آمیزی بستگی دارد.
حالا سیم های رابط را به الکتروفورز وصل نمایید و برای الکتروفورز در جریان الکتریکی ثابت، شدت جریان 20-30 میلی آمپر را تنظیم نمایید. در این حالت رنگ نشانگر (بروموفنل بلو) طی مدت 1.5 تا 2 ساعت به انتهای ژل میرسد.
پس از اتمام عمل الکتروفورز، جریان را قطع نمایید و دستگاه را از تانک بیرون آورید. سپس پیچ های آن را شل نمایید و شیشه های حاوی ژل را با دقت بردارید. با استفاده از کاردک همراه دستگاه به آرامی شیشه ها را از هم جدا کنید و ژل را برداشته. در صورت لزوم ژل را رنگ آمیزی کنید.
رنگ آمیزی نمونه ها در ژل آگارز
رنگ آمیزی پروتئین ها در ژل پلی اکریلآمید با روش های متنوعی امکان پذیر است. کوماسی بلو (انواع R و G) و نقره از پر استفاده ترین مواد برای رنگ آمیزی پروتئین ها هستند. در اینجا رنگ آمیزی با کماسی بلو که بسیار متداول میباشد، توضیح داده میشود.
رنگ آمیزی با کوماسی بلو R-250
کوماسی بلو R-250 معمولترین رنگ برای رنگ آمیزی پروتئین ها است. سادگی رنگ آمیزی، هزینه کم، ثبات رنگ برای مدت طولانی و حساسیت نسبتا بالا از مزایای آن می باشند.

حساسیت این روش 0.5-0.2 میکروگرم پروتئین در هر باند میباشد. در این روش مراحل تثبیت و رنگ آمیزی پروتئین ها به طور هم زمان صورت می گیرد.
مواد در تکنیک SDS-PAGE
· محلول رنگ آمیزی: 0.25 گرم کوماسی بلو R-250 را در 125 میلی لیتر متانول حل کنید. سپس 25 میلی لیتر اسید استیک گلاسیال و 100 میلیلیتر آب مقطر اضافه نمایید. غلظت رنگ در این محلول حدود 0.1 درصد وزنی/حجمی است. قبل از استفاده محلول رنگ را با کاغذ واتمن شماره 1 صاف کنید. این محلول میتواند به عنوان تثبیت کننده پروتئین ها نیز عمل کند.
· محلول رنگ بر: 200 میلیلیتر متانول، 100 میلیلیتر اسیداستیک گلاسیال و 700 میلی لیتر آب مقطر را به هم بیفزایید.
روش رنگ آمیزی در تکنیک SDS-PAGE
· ژل را در ظرف درب دار قرار دهید. حجم کافی از محلول رنگ (م ثلا 100 میلی لیتر برای یک ژل کوچک) اضافه کنید. در ظرف را بسته و آن را 1-2 ساعت روی شیکر قرار دهید. این مدت زمان برای رنگ آمیزی ژلی با غلظت 10 ٪ و ضخامت 1 میلی لیتر کافی است.
· محلول رنگ را تخلیه کنید. ژل را کاملا با آب معمولی شسته، سپس محلول رنگ بر اضافه کنید. در ظرف را بسته، آن را روی شیکر قرار دهید. پس از تیره شدن محلول رنگ بر، آن را با محلول تازه تعویض کنید. این عمل را چند بار تکرار کنید تا زمینه ژل شفاف گردد و باندهای پروتئینی به وضوح مشاهده شوند.
· ژل را در محلول 7 درصد اسیداستیک قرار دهید و در ظرف را ببندید. ژل در این حالت برای مدت طولانی قابل نگهداری است.
تعیین وزن مولکول در تکنیک SDS-PAGE
در تکنیک SDS-PAGE مولکول های پروتئینی با استفاده از سدیم دودسیل سولفات به صورت خطی در می آیند و حرکت آنها بر اساس وزن میباشد. همان گونه که پیشتر نیز ذکر شد، مسافت طی شده پروتئین ها با لگاریتم وزن مولکولی آنها رابطه خطی دارد. پس هرچه پروتئین بزرگتر باشد مسافت طی شده کمتر خواهد بود.
به طور معمول در زمان بارگیری نمونه ها، در یکی از چاهک ها مارکر پروتئینی نیز اضافه می کنند. مارکرهای پروتئینی متشکل از چندین پپتید با وزن مولکولی مشخص می باشند. با مقایسه نمودن میزان حرکت پروتئین مورد نظر بر روی ژل با مارکرهای پروتئینی با استفاده از رسم نمودار حرکت نسبی میتوان وزن مولکول هدف را تخمین زد.